一致性评价进展,7图详解
化学药一致性评价于2016年3月发文《国务院办公厅关于开展仿制药质量和疗效一致性评价的意见》启动至今已8个年头,一致性评价决定着国家化药集采的进度。
1、整体进展
一、整体进展
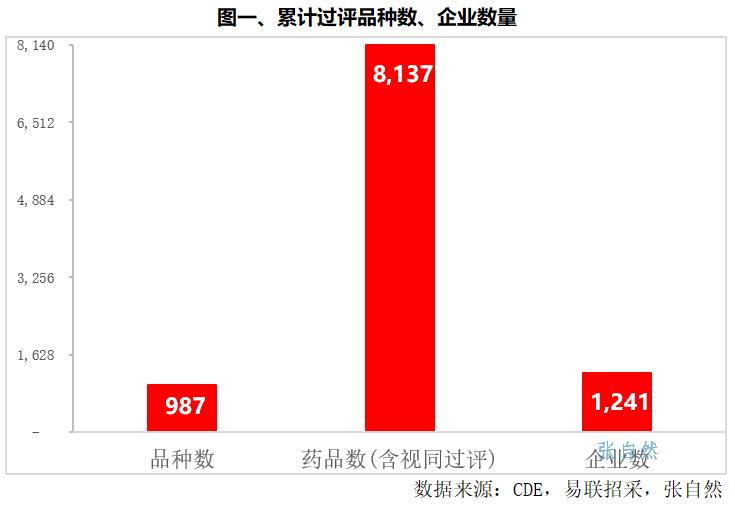
截至2023年12月18日,全国共有1241家企业的987个品种、8137个产品(不同企业生产的同一品种视为产品)。(详见图一)
二、年度进展
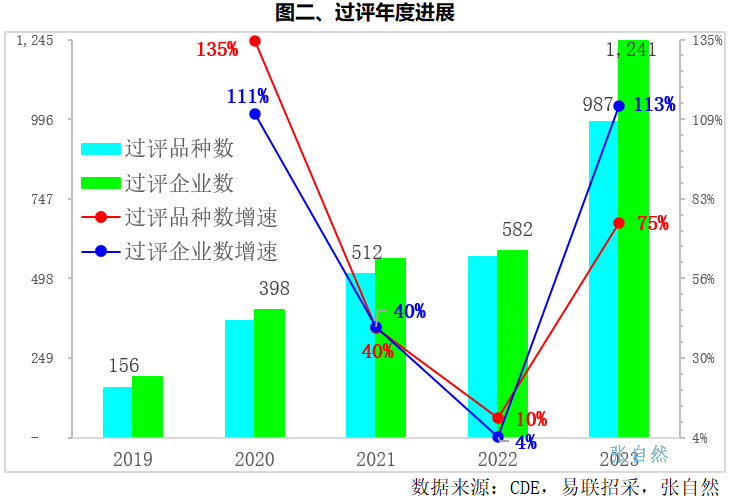
从年度来看,因疫情原因,2022年增速最小,过评品种数和过评企业数分别比上年增长了10%和4%,其他年度都以较快速度增长。其中,过评品种数由2019年的156个增加到了2023年的987个,4年增加了5.3倍,过评品种涉及企业数由2019年的189家增加到了2023年的1241家,4年增长了5.6倍。2023年过评品种数和涉及企业数均创历史新高,疫情过后一致性评价工作已全面恢复。(详见图二)
三、月度进展
申报数量多少透露了企业对一致性评价工作的积极性大小,通过数量的大小反映了主管部门的审批速度快慢。
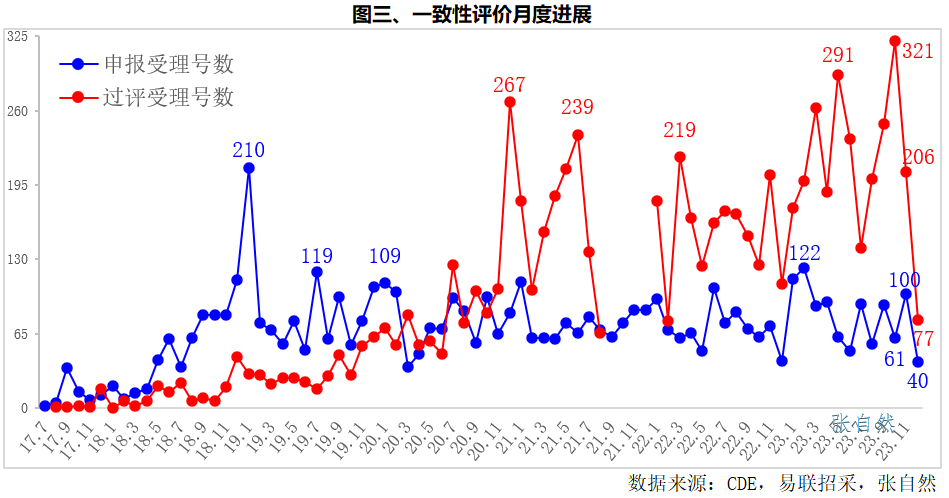
就申报受理号数来看,历史峰值发生在2019年1月份,申报受理号数多达210个,可能还是4+7开始前的惯性所致,在4+7开标前,大多认为集采旨在仿制药替代,受影响的主要是已过期的原研药,2019年2月申报受理号数骤降至74个,仅为1月份的1/3,4+7开标结果才让仿制药认清了现实,集采不但令原研药实现悬崖,而且仿制药也要大幅降价。
申报受理号数第二多的是2023年2月,为122个,一则疫情政策调整后各项工作逐步恢复,二则第八批国采恰于1月10号开始报量、于2月17号正式发文,令企业认识到集采的坚定不移,而化药参加国采必须先通过一致性性评价。
通过一致性评价的受理号数峰值发生在今年(2023年)1月,这是2022年12月7号疫情防控政策优化后的第一个月份,各个岗位已开始复工,同时第八批国采已于当月10号开始报量,企业为赶上第八批国采,促使审评部门提速也在情理之中。
其后过评受理号数最多的依次是2023年5月(291个)、2020年12月(267个)、2023年3月(262个),也是为赶上下批集采而促进了审批提速,如第四批国采于2020年12月10日开始报量,第九批国采于2023年3月2日正式发文、于3月29日开标。(详见图三)
02
企业
一、累计过评Top10企业
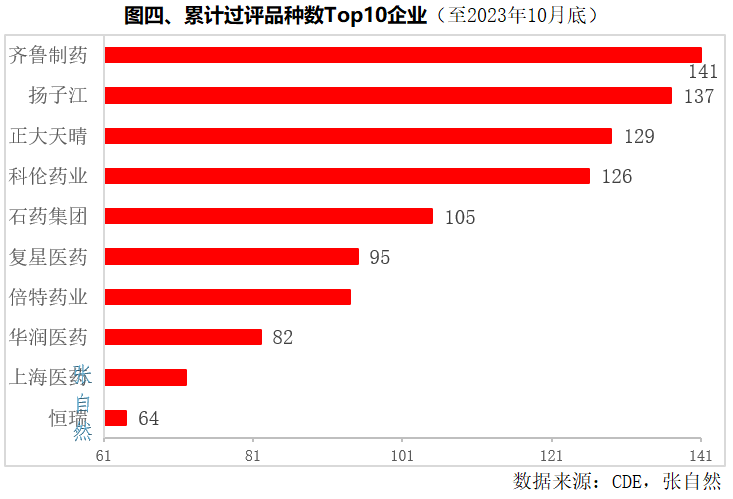
截至2023年10月,累计过评产品数最多的是齐鲁制药,过评多达141个。
其次是扬子江、正大天晴、科伦药业、石药也都超过了100个,分别为137个、129个、126个、105个。
而前八批国采中选产品数最多的也是上述5家企业,他们是我国仿制药的脊梁。
过评产品数排在第6~10位的分别是复星医药(95个)、倍特药业(94个)、华润医药(82个)、上海医药(72个)和江苏恒瑞(64个)。(详见图四)
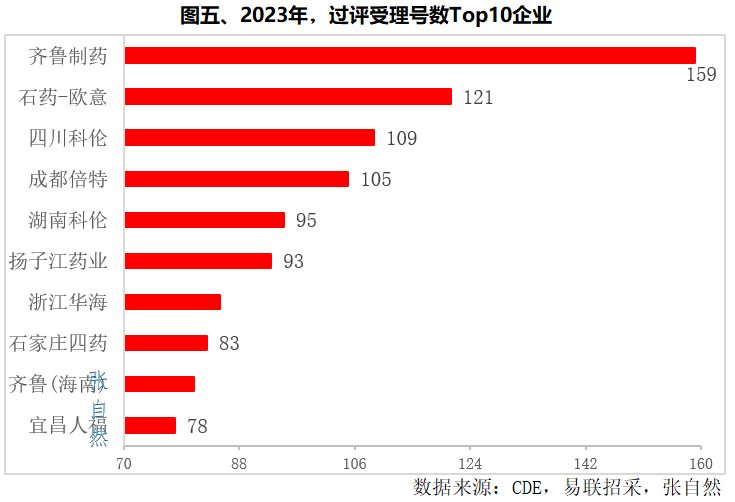
二、2023年过评Top10企业
截至12月18日,2023年当年过评受理号数最多的也是齐鲁制药,为159个。其次是石药集团欧意药业,为121个。
其次是,四川科伦和成都倍特也都超过了100个,过评受理号数分别为109个和105个。
过评受理号数超过80个的还有湖南科伦(95个)、扬子江(93个)、浙江华海(85个)、石家庄四药(83个)和齐鲁(海南)(81个)。(详见图五)
 03
03
品种
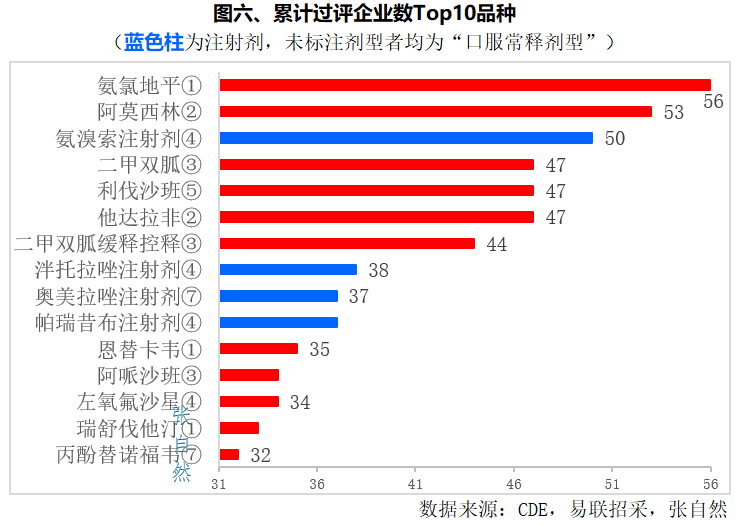
一、累计过评Top10受理号数
截至2023年12月18日,Top15品种累计过评受理号数都≥32个,其中,注射剂4个,占了1/4强。
其中,过评受理号数Top3品种是氨氯地平(第一批国采)、阿莫西林(第二批国采)两个口服常释剂型和氨溴索注射剂(第四批国采),都≥50个,分别为56个、53个和50个。
并列第三的是二甲双胍(第三批国采)、利伐沙班(第五批国采)和他达拉非(第二批国采)3个口服常释剂型,都有47个受理号过评。
二甲双胍缓释控释剂型位居第5位,有47个受理号过评,也已被第三批国家集采。
位居第6~8位的是3个注射剂,即泮托拉唑注射剂(第四批国采)、奥美拉唑注射剂(第七批国采)和帕瑞昔布注射剂(第四批国采),分别过评38个受理号、37个受理号和37个受理号。(详见图六)
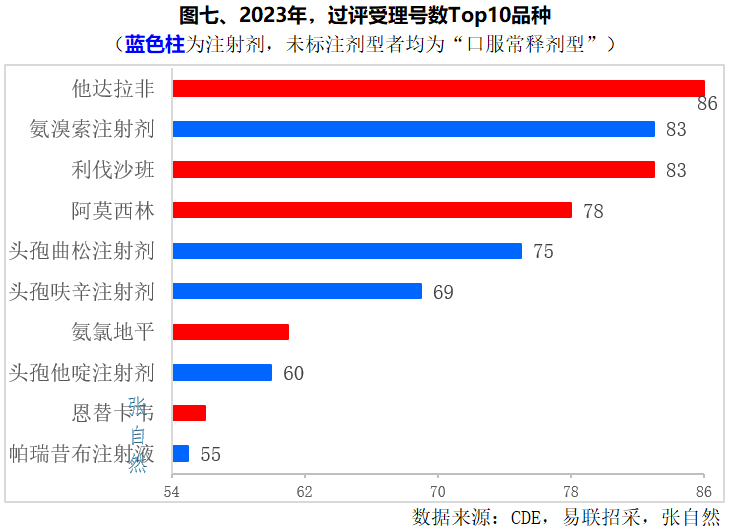
二、2023年过评Top10受理号数
截至12月18日,Top10品种都有55个及以上受理号过评,其中注射剂有5个,正好占了一半。
过评受理号数最多的是他达拉非口服常释剂型、氨溴索注射剂和利伐沙班口服尝试剂型,都有80个以上受理号过评,分别为86个、83个和83个。
其次是阿莫西林口服常释剂型和头孢曲松注射剂,也都超过了80个受理号过评,分别为78个和75个。(详见图七)
9月25日,国家药品监督管理局药品审评中心(CDE)发布《仿制药质量和疗效一致性评价受理审查指南(征求意见稿)》提出“自第一家品种通过一致性评价后,三年后不再受理其他药品生产企业相同品种的一致性评价申请”,针对新注册管理办法之前获批的存量仿制药将起到劝退作用,现有的仿制药批文或将迎来新一轮洗牌。长期来看有利于形成产业良性循环,促进中国仿制药行业的发展。
注:除图四外,本文数据均截止到2023年12月18日。
声明:本文系转载内容,图片、文字版权归原作者所有,转载目的在于传递更多信息,并不代表本平台观点。如涉及作品内容、版权和其它问题,请在本平台留言,我们将在第一时间处理。



