过去30年第二高!2023年FDA批准的55款新药
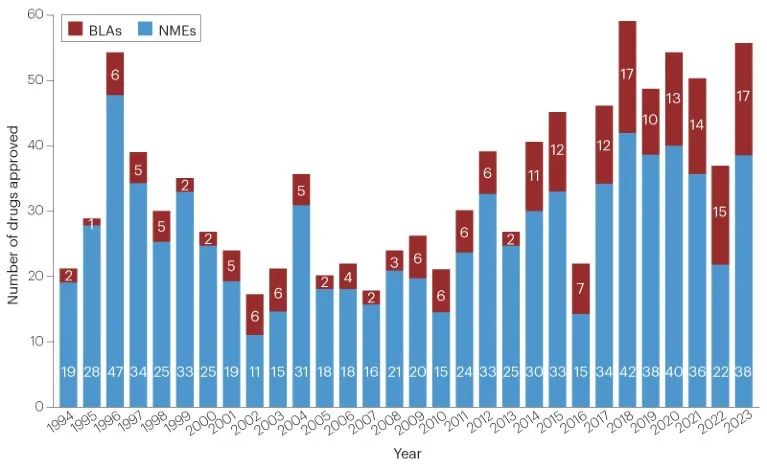
2023年,FDA的药物评价与研究中心(CDER)批准了55种新药,获批数量比2022年增长了近50%,仅次于2018年的59款。
此外,2023年FDA共批准了12款抗体新药,包括7款单抗(其中有一款国产PD-1)。
近10年来CDER批准的药物为每年46个,已经是20多年来的最高水平。
回顾2023
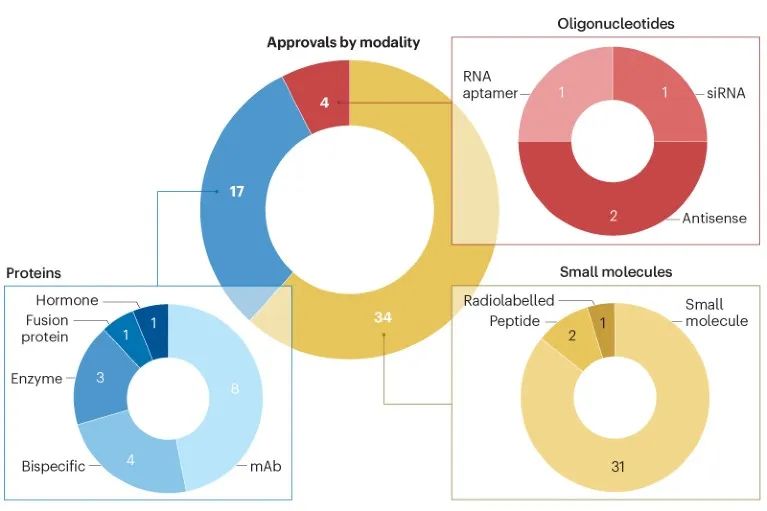
CDER批准的药物中,小分子药物的占比达到了55%,仍然占据半壁江山。此外,生物制品占到了31%左右。

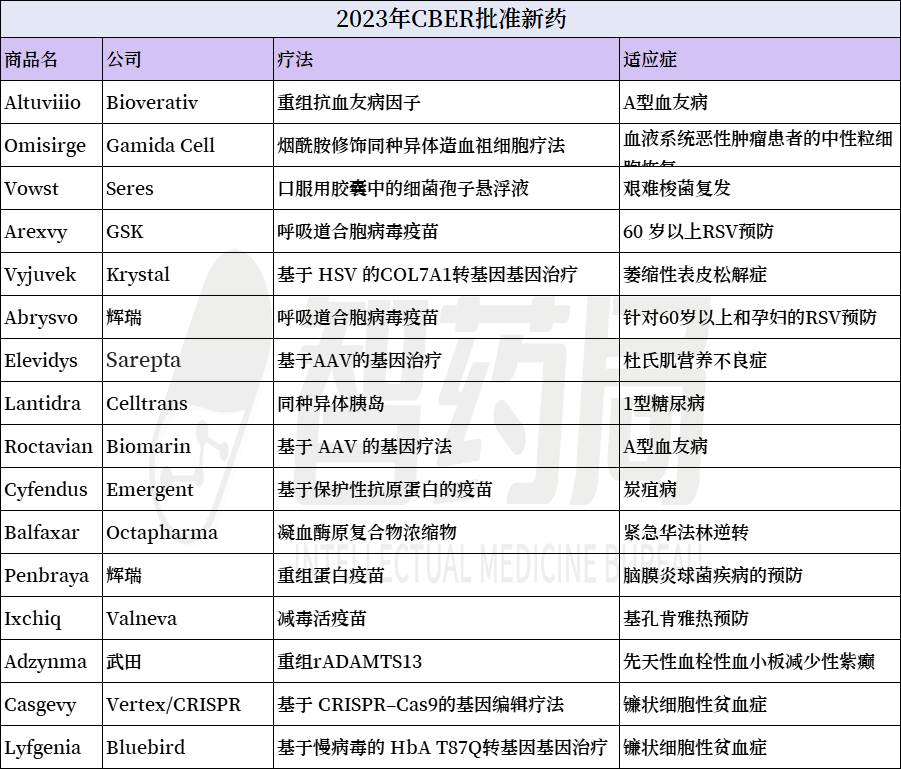
FDA的生物评估和研究中心(CBER)也紧跟步伐,在2023年批准了越来越多的细胞和基因疗法、疫苗和血液制品。
其中包括第一个基于CRISPR-Cas9的基因编辑疗法、两种呼吸道合胞病毒(RSV)疫苗和一系列基因疗法。
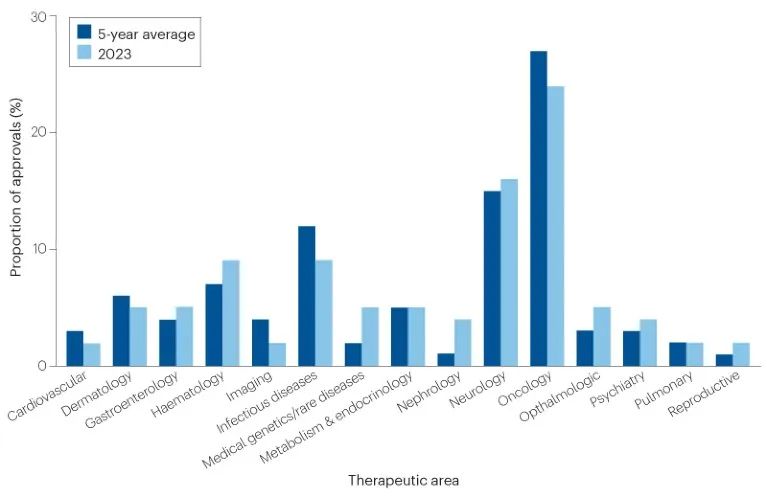
按治疗领域来看,肿瘤学继续获得最多的批准。2023年CDER批准了13种(24%)新癌症疗法。神经病学位居第二,有9种(16%)获得批准,也符合最近的趋势。传染病和血液病并列第三,各占5例(9%)。
CDER批准的药物按治疗领域分类
从治疗方式上看,疾病疗法继续变得更加多样化。2023年,基于核苷酸的疗法数量有所增加,其中包括第二种RNA适体产品。在抗体方面,FDA批准了4个双特异性抗体。
多个第一
第一个获得批准的AKT抑制剂
阿斯利康的capivasertib(Truqap)是第一个获得批准的AKT抑制剂。FDA批准其与雌激素受体拮抗剂氟维司群联合治疗PIK3CA、AKT1或PTEN中一种或多种生物标志物改变的HER2阴性转移性乳腺癌。分析师预测该激酶抑制剂的峰值销售额约为6.9亿美元。
两款RSV疫苗
2023年5月3日,葛兰素史克的呼吸道合胞病毒(RSV)疫苗Arexvy获美国FDA批准上市,用于预防60岁及以上人群由RSV引起的下呼吸道疾病。这也是全球首款获批的RSV疫苗。
同年5月31日,辉瑞的RSV疫苗Abrysvo也获得FDA批准上市,用于老年群体的预防。随后,Abrysvo适应症扩大,用于胎龄32至36周的孕妇,保护新生儿免受RSV感染,这也是首款用于孕妇群体的RSV疫苗。
这两种疫苗都可能达到重磅炸弹的地位。GSK的Arexvy目前处于领先地位,预计峰值销售额接近32亿美元。
Leqembi治疗阿尔茨海默病
卫材和百健的Leqembi(lecanemab)于1月份获得了针对阿尔茨海默病的加速批准,并7月后获得了全面批准。
Leqembi是一种人源化抗Aβ单克隆抗体,通过减少大脑中聚集的Aβ发挥疗效。与安慰剂(不含任何药物的输注)相比,Leqembi在1.5年期间将痴呆症状严重程度平均降低了27%。
分析师预测销售额峰值将达到48亿美元,由于曾经aducanumab在商业化的失败,分析师已经调低了该药物的销售预期。
首款CRISPR基因编辑疗法
Casgevy是第一个在全世界获批上市的基于CRISPR的基因编辑疗法,具有划时代的意义。该疗法一次性治疗定价为220万美元,分析师预计其峰值销售额将略高于26亿美元。
与CASGEVY疗法一起,FDA同时批准了Bluebirdbio公司的基因疗法LYFGENIA治疗复发性血管闭塞危象(VOC)的镰状细胞病(SCD)患者。
首款医药级口服粪便微生物产品
2023年4月26日,美国FDA宣布,批准SeresTherapeutics和雀巢的口服微生物组疗法Vowst上市。这是FDA批准的首款口服粪便微生物组疗法,也将打开微生物疗法的新大门。
2024值得关注的药物
进入2024年,多款药物的即将获批也备受市场关注。
FDA已经接受安斯泰来Zolbetuximab生物制剂许可申请并授予优先审查资格,如果成功的话,将成为首个CLDN18.2抗体,用于治疗胃癌。
此外,MadrigalPharmaceuticals的THR-β激动剂Resmetirom治疗NASH的上市申请获得FDA受理并被授予优先审评资格,如果成功获批上市,Resmetirom将成为NASH开创里程碑的创新药。
Moderna的RSV疫苗mRNA-1345的批准将表明mRNA疫苗平台具有超越COVID-19的潜力,对于mRNA未来也非常重要。
Iovance的lifileucel则将成为首款获批治疗实体瘤的T细胞疗法,治疗转移性黑色素瘤,这也将成为TIL疗法35年来的重要里程碑。

文章图片来源:智药局官微
参考链接:
https://www.nature.com/articles/d41573-024-00001-x
声明:本文系转载内容,图片、文字版权归原作者所有,转载目的在于传递更多信息,并不代表本平台观点。如涉及作品内容、版权和其它问题,请在本平台留言,我们将在第一时间处理。



